研究背景
自身免疫性疾病,如系统性红斑狼疮(SLE)、类风湿关节炎(RA)和1型糖尿病等,是由于机体自身免疫耐受出现异常的结果。一般情况下,机体有一系列控制自身反应性T、B细胞的机制。克隆消除是免疫系统发展过程第一位的选择机制,又称阴性选择。克隆消除是一种中枢耐受,它可以将对自身抗原产生应答的T细胞进行清除。但是,这一机制并不彻底,一些自身反应性T细胞可以从这一消除机制中逃逸,从而进人外周系统造成全面破坏。为了调节这些可能产生自身损害的T细胞,机体在外周系统产生了外周耐受,包括克隆无能、外周清除、免疫忽视和一系列调节性T细胞(Treg)。当机体Treg的数量减少或功能减退时,便会出现自身免疫性与变态反应性疾病。如下图所示。
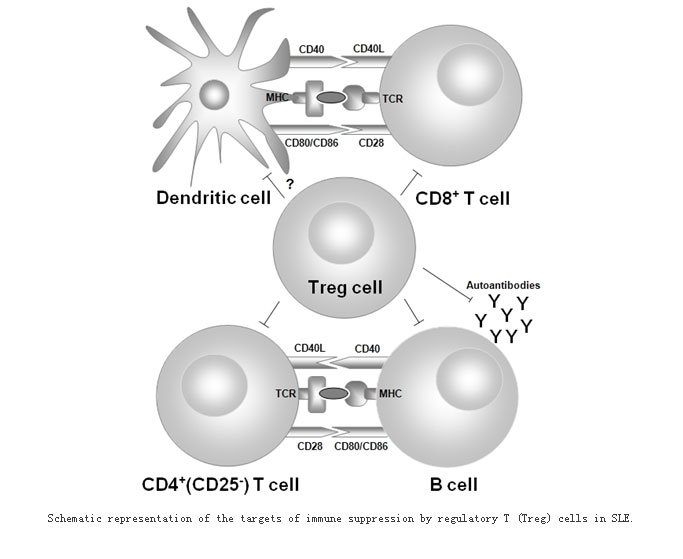
Treg种类非常多,根据细胞表面CD4分子是否表达可分为CD4+Treg细胞与CD4-Treg细胞。CD4+Treg在数量上约占人体内外周系统CD4+T细胞的1%-2%。其他Treg尚处于探索阶段。CD4+Treg可分为自然Treg(nTreg)和适应性Treg(iTreg)。nTreg是目前研究最多的Treg种群,最早由Sakaguchi等发现部分CD4+T细胞可高表达IL-2受体的α链(CD25),并证实具有免疫调节性。CD25是最早被证实的Treg标志物,但它也表达于活化的CD4+T细胞。一些研究表明CD127(IL-17受体的α链)可鉴别人类Treg与活化的CD25+T细胞,Treg被认为是CD127low,活化的CD25+T细胞被认为是CD127high。Foxp3是Treg发育与功能表达过程中的一个重要转录因子,也是重要的鉴别标志物。
Sakaguchi等最早证明了Treg在自身免疫反应进展中的重要性。将CD4+中的CD4+CD25+T细胞去除,在特异性抗CD25抗体辅助下注入无胸腺的小鼠体内,结果小鼠出现一系列自发的自身免疫疾病,如甲状腺炎、胃炎、胰岛炎、肾小球肾炎、多关节炎等。再用CD4+CD25+T细胞注入上述小鼠体内替换CD4+CD25-T细胞,上述自身免疫性疾病均得到了有效的控制。Treg发挥调节作用的主要机制有:(1)分泌抑制性细胞因子,如IL-10、TGF-β和IL-35,并促进其发挥效应。(2)分泌穿孔素与颗粒蛋白酶。(3)代谢破坏,Treg通过对生长性细胞因子IL-2的剥夺使效应性T细胞凋亡。(4)对抗原递呈细胞增殖和功能的抑制性调节。
一直以来,对于人类RA的研究往往倾向于量化外周血中的Treg细胞,同时在免疫反应中进行定位。在RA患者中,滑液中的Treg比外周血中的Treg要高一些,累积在炎症关节中的Treg高水平表达CTLA-4、糖皮质激素诱导的肿瘤坏死因子受体(GITR)、OX-40和Foxp3。一些关于健康人群与RA患者循环系统中Treg的数量比较研究,均未得出显著性结果或呈现互相矛盾结果。一些研究结果表明RA患者Treg水平下降,但也有相当一部分研究未发现两组人群的显著差异或RA患者Treg水平增高。尽管RA患者滑液中Treg的增多可以抑制T细胞的增殖与促炎细胞因子(TNF-α、IFN-γ)的释放,但是炎症反应仍然可以继续发生。滑液中效应性T细胞与循环系统中效应性T细胞相比,其对Treg调节作用的敏感性较低。这些数据与高度活化的CD4+T细胞对Treg调节作用的抵抗现象相符合。
研究模型
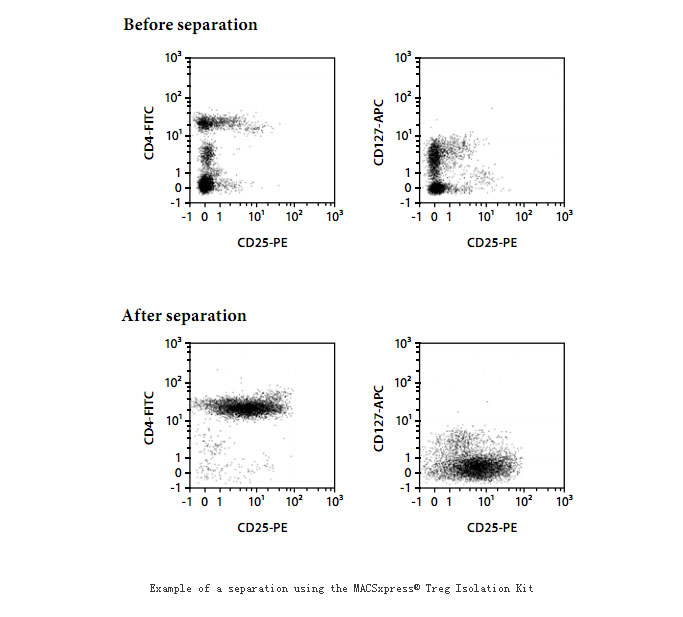
我们已经掌握了调节性T细胞的原代分离培养:制备单个细胞悬液,以T细胞纯化柱分离小鼠淋巴结或脾脏T淋巴细胞,以抗CD8-FITC抗体和抗FITC标记磁珠相结合的阴性选择法剔除CD8+T细胞,再以抗CD25-FITC抗体和抗FITC标记磁珠相结合的阳性选择法选出CD25+T淋巴细胞。也可采用CD4+T细胞亚型纯化柱分离得到CD4+T细胞,再结合抗CD25-FITC抗体,以流式细胞仪分选出纯化的CD4+CD25+T细胞。如下图所示。
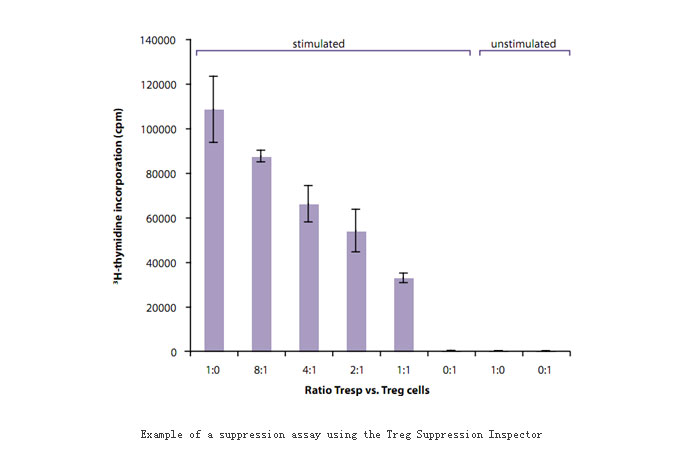
我们建立了调节性T细胞抑制功能检测模型:将Treg与CD4+CD25–或CD4+应答性T细胞(Tresp)以不同的比例共培养,并加入多克隆刺激剂。单独的Tresp细胞会有很快的增殖反应(anergy)。而二者共培养后会导致Tresp细胞的增殖减弱。抑制实验可以使用Tresp与Treg细胞的不同比例,如从1:1到8:1,作为对照,可以将Treg和Tresp细胞在加检测剂和不加检测剂的情况下单独培养。如下图所示。
研究案例
目的:探明类风湿关节炎(RA)时调节性T细胞和Th17细胞这两种亚群在外周血中的分布特征,进一步分析导致该免疫状态的分子机制,明确Notch信号分子在RA外周血T细胞中的表达特性
结论:RA患者外周血存在Treg/Th17失衡;Th1和Th17相关的细胞因子增多,外周血T细胞内Notch信号呈显著活化状态。
路线:
-
选取活动期及稳定期RA患者,采取流式细胞术细胞内染色技术检测外周血中调节性T细胞和Th17细胞百分比,并应用qPCR检测这两种细胞特异的转录因子FoxP3和ROR的表达水平
-
RA患者同时检测调节性T细胞和Th17细胞百分比,计算Th17/Treg比值。同时采用流式芯片技术检测血清中11种细胞因子,观察外周血中细胞因子微环境特征,并分析与Th17/Treg比值的相关性
-
采用流式细胞术检测RA外周血T细胞Notch受体分子的表达。应用免疫磁珠分离纯化外周血T细胞,通过qPCR检测Notch受体及靶基因表达水平。应用WB检测T细胞内Notch胞内段核移位。
核心文献
-
Interleukin-35 induces regulatory B cells that suppress autoimmune disease.
Nat Med. 2014 Jun;20(6):633-41.
http://www.ncbi.nlm.nih.gov/pmc/articles/pmid/24743305/
-
Good guys gone bad: exTreg cells promote autoimmune arthritis. Nat Med. 2014
Jan;20(1):15-7. http://dx.doi.org/10.1038/nm.3439
-
Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune
arthritis. Nat Med. 2014 Jan;20(1):62-8. http://dx.doi.org/10.1038/nm.3432
-
TNF-α trips up Treg cells in rheumatoid arthritis. Nat Med. 2013
Mar;19(3):269-70. http://dx.doi.org/10.1038/nm.3124
-
Phosphorylation of FOXP3 controls regulatory T cell function and is
inhibited by TNF-α in rheumatoid arthritis. Nat Med. 2013 Mar;19(3):322-8.
http://dx.doi.org/10.1038/nm.3085


