研究背景
肝纤维化是指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程。它不是一个独立的疾病,许多慢性肝脏疾病均可引起肝纤维化。其病因大致可分为感染性(慢性乙型、丙型和丁型病毒性肝炎,血汲虫病等),先天性代谢缺陷(肝豆状核变性、血色病、α1-抗胰蛋白酶缺乏症等)及化学代谢缺陷(慢性酒精性肝病、慢性药物性肝病)及自身免疫性肝炎、原发性肝汁性肝硬化和原发性硬化性胆管炎等。
在正常肝组织中,各种细胞及细胞外基质有精确的相对比例和特定的相对空间位置,通过细胞之间、细胞与细胞外基质之间的信号传递精确地调控着结构、功能和代谢状态,成为一个相对稳定的微生态系统。从动态的观点来看,纤维增生是指各种细胞外基质合成增加,而纤维分解则是指细胞外基质的降解过程;肝纤维化的发生、发展和转归取决于二者的“净效应”。急性肝损害所致肝脏纤维增生是机体对于肝实质损伤的一种修复反应,一旦病因去除则过多的细胞外基质被降解,肝组织内细胞内细胞与基质万分恢复正常,因而不产生肝脏纤维化。但慢性肝病所致的持续或反复的肝实质炎症坏死可引起纤维结缔组织大量增生、而其降解活性相对或绝对不足,因此大量细胞外基质沉积下来形成肝纤维化。如果肝纤维化同时伴有肝小叶结构的破坏(肝再生结节),则称为肝硬化。但是,在临床上难以将两者截然分开,因为慢性肝病由肝纤维化到肝硬化是一个连续的发展过程。近年的基础和临床研究表明,如果能给予有效的病因治疗,或能直接抑制细胞外基质的合成和/或促进其降解,则已经形成的肝纤维化甚至早期肝硬化也是可以逆转的。
肝星状细胞的持续激活是肝纤维化发生发展过程中的关键环节(如下图所示)。激活的肝星状细胞一方面通过增生和分泌细胞外基质,参与肝纤维化的形成和肝内结构的重建,另一方面通过细胞收缩使肝窦内压升高,这两类变化最终奠定了肝纤维化、门静脉高压症发病的病理学基础。肝星状细胞的激活过程十分复杂,包括两个主要阶段:启动阶段及持续阶段。持续阶段则是这些刺激因素维持肝星状细胞的活化表型,结果引起肝纤维化的形成。启动阶段主要是依赖于旁分泌刺激因素。而持续阶段则与旁分泌、自分泌刺激因素均有关。
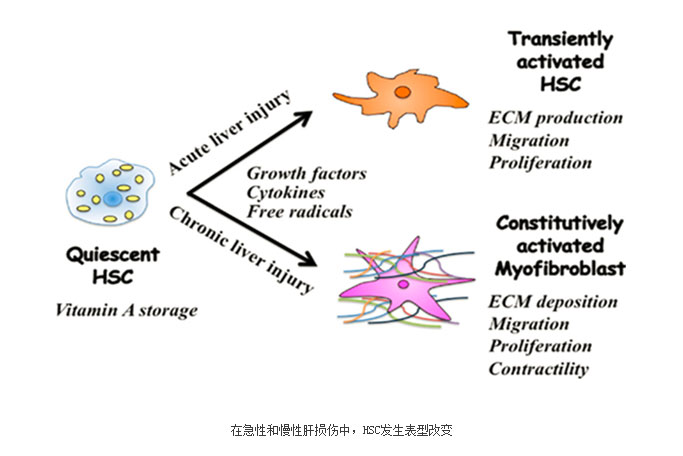
肝星状细胞激活的启动阶段是指早期基因表达的改变及在细胞因子等刺激因素作用下产生的细胞表型改变。当肝实质细胞受到损伤时,邻近的肝细胞、库普弗细胞、窦内皮细胞和血小板等通过旁分泌作用可分泌多种细胞因子,如肿瘤坏死因子α(TNF-α)、转化生长因子β(TGF-β)、胰岛素生长因子(IGF-1)、肝细胞生长因子(HGF)、血小板源性生长因子(PDGF)、内皮素(ET)-1等,作用于HSC并使之出现肌成纤维母细胞(myofibroblast,MFB)样表型转化,激活并导致细胞增殖、ECM合成增加等。激活后的肝星状细胞可自分泌TGF、PDGF、ET等细胞因子使活化得以持续,此时即使除去原发因素纤维化仍会持续。
肝星状细胞激活的持续阶段指由于上述各种因子的作用而维持星状细胞的激活状态并有纤维形成。肝星状细胞活化的持续阶段有以下特征性的变化,这些改变的直接或间接效应是增加ECM的沉积。此阶段肝星状细胞的活化受自分泌和旁分泌的双重调节。(1)细胞增殖:PDGF是肝星状细胞的最强丝裂原,肝星状细胞活化早期PDGF受体增强了肝星状细胞对这种丝裂原的反应;(2)细胞趋化聚集:肝星状细胞能向化学趋化剂的部位移动,在一定程度上解释了为什么肝星状细胞在肝内多分布在炎性间隔内;(3)纤维形成:增加基质形成是肝星状细胞活化导致肝纤维化的最直接途径。一方面,ECM合成的量增加;另一方面,合成的ECM种类异常,在正常情况下,肝星状细胞以合成型胶原为主。而活化后则以产生型胶原为主;(4)细胞的收缩作用:肝星状细胞的收缩作用可能是引起肝纤维化后门静脉阻力增加的重要因素。晚期肝硬化典型的纤维带中充满着大量肝星状细胞,活化的肝星状细胞通过收缩窦周和收缩硬化的肝脏阻碍门静脉血流。引起肝星状细胞收缩的主要刺激因子是内皮素-1,其受体在静止或活化的HSC均有表达;(5)基质降解:在肝纤维化过程中,伴随着ECM重构,基质蛋白酶质和量的改变起重要作用。肝星状细胞几乎能表达基质降解所需要的所有关键成分,因此,活化的肝星状细胞不仅在ECM生成过程中起作用,而且在ECM降解过程中也起重要作用。(6)白细胞趋化及释放细胞因子:除了肝脏内多种细胞因子通过旁分泌发挥作用外,肝星状细胞自分泌的细胞因子对其活化的持久延续也很重要。活化的肝星状细胞自分泌TGF-B以及ET-1。分别导致肝星状细胞产生大量ECM和具有收缩性。肝星状细胞还能通过诱导单核巨噬细胞浸润来扩大炎症效应。
研究模型
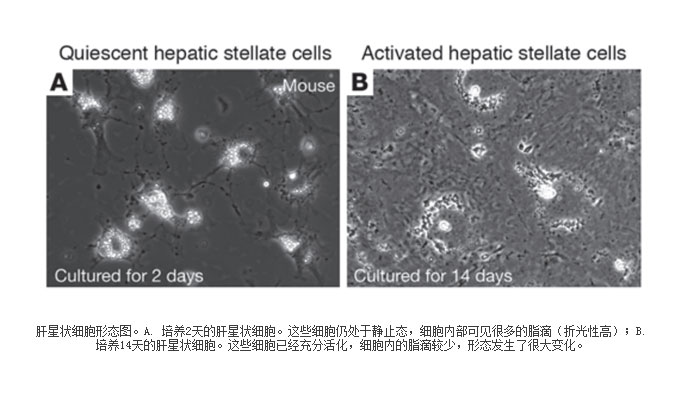
我们已经掌握了对原代肝星状细胞HSC进行分离培养的技术:经肝门静脉先用不含钙镁离子的Hank液充分灌洗,再以浓度为1mg/mL的Ⅳ型胶原酶灌注肝脏;取肝后,完整分离后碾碎,37℃水浴振荡30min,Percoll连续密度梯度(60%)离心法分离、纯化HSCs;苔盼蓝染色检测HSCs活性,采用蛋白免疫细胞化学鉴定HSCs,光镜观察体外培养HSCs的形态学变化。刚分离出来的原代HSC直径约10
um,呈圆球形,胞浆内含有大量典型的高折光性的颗粒,24h后,绝大多数的细胞已贴壁,多呈圆形或椭圆形,少数呈梭形。2-3天后,细胞开始伸展,胞体增大呈多边形,少数已伸出伪足呈星型。5-7天后,细胞继续伸展,折光性的颗粒渐减少,绝大多数的细胞呈星型,部分细胞相互融合呈片状。HSC的形态图如下所示。
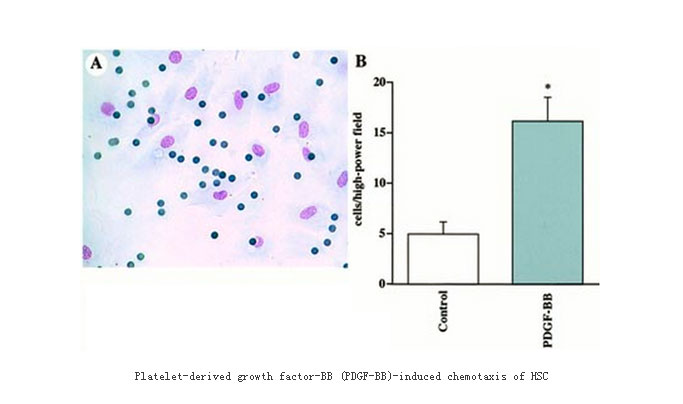
活化的肝星状细胞具有增殖、收缩、调节肝窦张力与血流、分泌细胞因子、产生基质金属蛋白酶及其抑制物、合成大量细胞外基质等功能。而细胞迁移是对组织损伤及炎症反应所必需的,防止特定类型细胞迁移可抑制疾病进展。肝纤维化进程中HSC亦能表现出迁移的特性,可导致炎症区域活化的HSC数目增多。因此为明确细胞因子、胶原对活化的HSC迁移功能的影响,我们建立了HSC细胞迁移的评价模型。PDGF是目前已知多肽生长因子中对HSC作用最强的有丝分裂原,已知PDGF与受体结合后可经Ras激活局部粘附激酶(FAK)酪氨酸磷酸化,从而促HSC增殖、趋化。我们实验证实其直接及趋化刺激均可增加肝星状细胞迁移(如下图所示)。
研究案例
目的:阐明氟非尼酮(AKF-PD)抗肝纤维化的作用机制
结论:抑制肝星状细胞的活化和增殖是AKF-PD治疗肝纤维化的机制之一
路线:
-
采用DMN诱导的大鼠肝纤维化模型,并予以AKF-PD进行干预;行HE和Masson染色,观察其对肝纤维化的影响,同时观察其对DMN大鼠肝脏I、III型胶原以及α-SMA表达的影响
-
采用原位循环灌流和密度梯度离心方法分离大鼠原代肝星状细胞
-
通过体外细胞实验,观察AKF-PD对PDGF诱导的大鼠原代肝星状细胞活化与增殖的影响
-
探讨AKF-PD是否通过抑制ERK/MAPK及PI3K/Akt信号转导通路影响肝星状细胞的活化与增殖
核心文献
-
Hepatic stellate cells in liver development, regeneration, and cancer. J
Clin Invest. 2013;123(5):1902–1910. http://www.jci.org/articles/view/66369
-
Hepatic stellate cells contribute to progenitor cells and liver
regeneration. J Clin Invest. 2014;124(12):5503–5515.
http://www.jci.org/articles/view/74119
-
Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the
liver. Physiol Rev. 2008;88(1):125–172.
http://www.ncbi.nlm.nih.gov/pubmed/18195085
-
Mesenchymal origin of hepatic stellate cells, submesothelial cells, and
perivascular mesenchymal cells during mouse liver development. Hepatology.
2009;49(3):998–1011. http://www.ncbi.nlm.nih.gov/pubmed/19085956
-
Myofibroblastic cells function as progenitors to regenerate murine livers
after partial hepatectomy. Gut. 2014;63(8):1333–1344.
http://www.ncbi.nlm.nih.gov/pubmed/24173292


