研究背景
细胞自噬是真核生物中高度保守的依赖于溶酶体的降解过程,在维持细胞物质代谢、内环境稳定及基因组完整性等方面起重要作用。自噬功能紊乱与机体多种疾病的发生密切相关。近年来,大量的研究表明,人类多种肿瘤中存在自噬异常,自噬在肿瘤发生发展的各个阶段均扮演着重要角色。
细胞自噬(autophagy)是细胞内重要的物质分解代谢过程,通过双层膜结构的自噬泡(autophagosome)包裹错误蛋白或受损细胞器,与溶酶体(lysosome)融合,经溶酶体酸性水解酶水解作用产生氨基酸等生物分子,并最终被细胞重新利用,实现细胞内物质的循环,如下图所示。早在1956年,Clark利用电子显微镜观察新生小鼠肾组织时发现细胞中含有大量具有膜性结构的致密体,且其中常含有类似于线粒体等的胞质结构。1963年的国际溶酶体大会上,Christian de Duve将这种细胞中存在的包裹细胞质和细胞器的膜泡发生现象定义为自噬。直至1993年Tsukada和Ohsumi在酵母(Yeast)中发现第一个自噬相关基因Atg(autophagy-related gene)后,人们对自噬的研究有了新的进展。近年来大量的研究表明,自噬与肿瘤的发生发展密切相关,许多调节自噬的药物被用于临床肿瘤治疗的研究中。
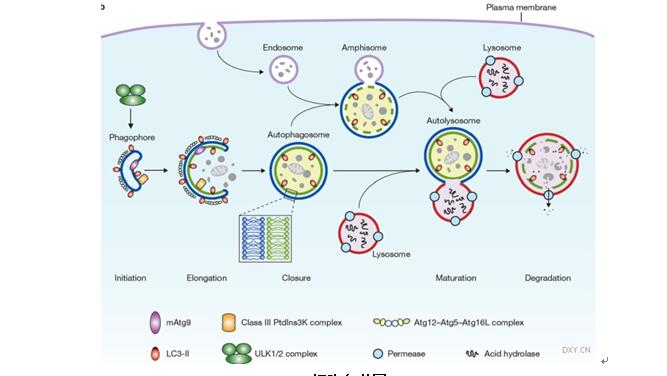
细胞自噬图
虽然正常的自噬发生对肿瘤的发生具有抑制作用,但在肿瘤形成后,部分肿瘤细胞能利用自噬对抗应激环境,增强存活能力。特别在实体瘤中,需要更多的氧气和营养物质来保持快速增殖,造成细胞中营养缺乏和低氧胁迫。作为细胞应激状态下提供营养物质的重要途径,自噬可以保护肿瘤细胞,避免凋亡或坏死的发生。研究表明,在KrasG12D(编码持续激活形式的KRAS)和BrafV600E(编码持续激活形式的B-Raf)构建的肺癌模型中,自噬缺陷可以逆转恶性的腺瘤(adenoma)和癌(carcinoma)为良性的嗜酸细胞瘤(ncocytoma)。此外,自噬可能还提供一些代谢中间产物来满足肿瘤细胞特殊的代谢需求;并且多种类型肿瘤细胞系在营养充足条件下也具有高水平的基础自噬。
自噬还可以减少细胞失巢凋亡(anoikis)的发生,提高肿瘤细胞的转移能力。细胞与细胞外基质或相邻细胞脱离接触会诱发失巢凋亡,扩散的肿瘤细胞必须具备抗失巢凋亡的能力才能脱离原发灶并在转移过程中存活。研究发现,细胞脱离细胞外基质时,自噬被激活而帮助细胞抵抗凋亡;用RNA干扰技术敲低Atg5或Atg7的表达,抑制细胞自噬,能促进肿瘤细胞的失巢凋亡。
化疗、放疗后,肿瘤细胞会产生大量受损的蛋白质和细胞器等有害成分,此时自噬活性提高,及时清除有害物质并提供应急的原料和能量,为DNA损伤修复提供条件,导致肿瘤治疗预后较差。而放、化疗时结合自噬抑制药物能起到更好的抑癌效果。
自噬与肿瘤发生的关系可能是双重的:(ⅰ)在肿瘤发生发展的不同阶段,自噬的作用可能不同。肿瘤发生的早期阶段,自噬障碍可以增加基因组的不稳定性,促进癌变过程;肿瘤快速生长和转移阶段,自噬可以抵抗应激条件以及抑制失巢凋亡,维持肿瘤细胞的生存;(ⅱ)自噬对于单个细胞和整个肿瘤组织的作用可能不同。自噬缺陷的肿瘤细胞易于坏死,但是坏死所引起的炎症反应反而会促进肿瘤的生长与侵袭。从某种意义上讲,无论对于哪种类型的细胞而言,自噬都可以看作是一种保护机制。自噬一方面能够保护正常细胞,防止癌化的发生;另一方面又能够增强肿瘤细胞的生存能力,在应激条件下对其起到保护作用。自噬与肿瘤之间的关系是复杂多样的,仍需大量的深入研究来阐明自噬和肿瘤发生间的清晰联系。
作为真核细胞中重要的分解代谢过程,自噬的分子细胞机理和生理病理意义正在被逐渐认识和解析。然而,有关自噬相关基因的功能和自噬发生机制还有很多问题有待澄清,如自噬泡膜的来源、降解底物的识别以及自噬泡与溶酶体的融合机制等。加深自噬机制的研究不仅具有深刻的理论意义,同时具有非常重要的应用价值,尤其在肿瘤的临床治疗中。
自噬在肿瘤发生发展中的作用尚无清晰的定论;随着对自噬作用机制的研究深入,期待对自噬更深层次的理解,并为肿瘤发病机制的研究和肿瘤治疗提供新的思路。虽然作用于自噬过程的抗肿瘤药物的研究有了初步的进展,但目前大部分药物的作用靶点缺乏选择性,对肿瘤细胞自噬的干扰缺乏特异性;寻找能够直接作用于自噬过程,且特异性强的药物将是未来抗肿瘤研究的新方向。此外,到目前为止虽然激活细胞自噬来预防肿瘤发生的直接临床依据稍显不足,但自噬在肿瘤早期发生过程中的抑制作用已被广泛证实,因此适当地提高基础自噬水平可能成为未来肿瘤预防的重要措施。
研究模型
我们建立了RFP-GFP-LC3 串联体用于检测自噬:mRFP用于标记及追踪LC3,GFP的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP 荧光发生淬灭,此时只能检测到红色荧光。我们在显微镜成像后红绿荧光merge后通过merge后出现的黄色斑点即只是自噬体.红色的斑点指示自噬溶酶体,通过不同颜色斑点的计数可以清晰的看出自噬流的强弱。如下图所示。
研究案例
目的:研究XIAP在负调节自噬通路方面的新功能
结论:凋亡抑制蛋白XIAP能够通过抑制自噬,促进肿瘤生成,以及影响癌症进程
路线:
XIAP生理条件下参与抑制自噬的发生(XIAP的缺失增加了GFP-LC3形成点状聚集的细胞比例;WB分析也表明,XIAP的缺失极大地增强了内源性LC3的转换)
XIAP部分依赖于胞质p53途径影响自噬(siRNA介导的XIAP基因敲除均能导致MDM2蛋白水平的显著增加和p53蛋白水平的大幅下降,而且伴随着LC3转换的增强)
XIAP是MDM2的一个新E3泛素连接酶
XIAP调节血清饥饿诱导的自噬
XIAP抑制自噬作用受到AKT磷酸化的调控
XIAP影响DNA损伤应答的起始
核心文献
Autophagy maintains stemness by preventing senescence. Nature. 2016 Jan 7;529(7584):37-42. http://dx.doi.org/10.1038/nature16187
DNA damage and the balance between survival and death in cancer biology. Nat Rev Cancer. 2016 Jan;16(1):20-33. http://www.ncbi.nlm.nih.gov/pubmed/26678314
Glioma: Repurposed drugs combined to amplify autophagy. Nat Rev Cancer. 2015 Nov;15(11):636. http://dx.doi.org/10.1038/nrc4033
Autophagy: Surviving stress in pancreatic cancer. Nat Rev Cancer. 2015 Sep;15(9):513. http://dx.doi.org/10.1038/nrc4005
Autophagy: Exploring the anticancer effects of autophagy inhibition. Nat Rev Cancer. 2015 Sep;15(9):512-3. http://dx.doi.org/10.1038/nrc4003
Copyright © 2008 - 2018 上海诺百生物科技有限公司 版权所有
技术咨询信箱:techsupport@novobiosci.com 订单查询信箱:sales@novobiosci.com
地 址:上海市闵行区顾戴路3100弄789号2楼 苏ICP备12010280号