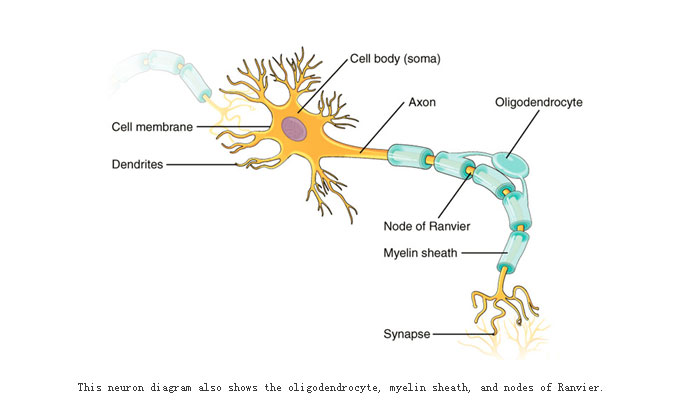
少突胶质细胞是CNS中形成髓鞘的一类大胶质细胞(如下图所示),神经元轴突髓鞘的形成可以确保神经电信号快速和精准的传导。当CNS受到损伤破坏后,少突胶质细胞在病理条件下要经历脱髓鞘、凋亡、前体细胞增殖和再髓鞘化等一系列过程。但是,基础和临床研究都表明,在神经损伤的病理条件下,少突胶质细胞自发的再髓鞘化比例非常低,严重阻碍了神经再生与修复。如何有效治疗中枢神经损伤已成为世界性的医学难题。成体神经组织中存在大量的少突胶质前体细胞(OPC),理论上这些细胞应该具有分化且形成髓鞘的潜力。为何神经损伤后这些OPC不能有效分化和形成髓鞘一直是困扰科学家的难题。一个可能原因是成年神经组织的微环境发生了改变,缺少促进OPC分化的胞外信号,导致OPC分化和髓鞘化无法有效进行。由于增加细胞外因子会影响CNS的许多其他功能,因此解决这个难题的一种有效策略就是:直接和特异性地改变与分化相关的少突胶质细胞内信号网络,促进OPC分化和髓鞘化,从而达到再生修复的目的。
一些中枢部位修复失败的原因是由于在损伤区存在有抑制OPCs分化的因素:Notch通路系统与少突胶质细胞分化关系密切。组织病理学研究发现,星型胶质细胞表达Jagged-1,作用于少突胶质细胞Notch-1受体,使聚集在损伤周围的OPCs成熟及分化受到抑制,从而抑制少突胶质细胞成熟,导致髓鞘修复障碍。有研究者推测y一分泌酶缺失才是使髓鞘再生失败的主要原因,分泌酶是一种Notch信号的抑制因素,它可以阻止Notch信号的传导。在脑发育阶段,Olig2及其同源异构体Nkx2.2的表达是OPCs分化成少突胶质细胞必需的转录因子,这两种蛋白表达启动髓鞘基因表达。PDGF是胎儿OPCs的有丝分裂原,但它不仅调控OPCs数量,还影响细胞分化。在Cuprizone诱导脱髓鞘模型时,小鼠实验提示PDGF在成人髓鞘修复过程中起关键作用。
研究模型
我们已经掌握了对少突胶质前体细胞OPC进行分离培养的技术,并建立体外分化模型,以模拟体内OPC的发育过程。取胚胎大鼠,于手术显微镜下取出脊髓,用胰酶消化后加入OPC培养液,吹打促使细胞从脊髓组织中解离;吸取细胞悬液,通过非特异性差异黏附法与A2B5-IgM抗体免疫筛选法结合,从胚胎大鼠脊髓来源的细胞悬液中分离、纯化OPCs,用含成纤维细胞生长因子-2和血小板源性生长因子的培养液作扩增培养。用于体外诱导分化的OPC种植于特殊包被的盖玻片上,加入三碘甲状腺氨酸和神经营养因子-3诱导OPCs分化,最终分化为成熟的少突胶质细胞(OLs)。
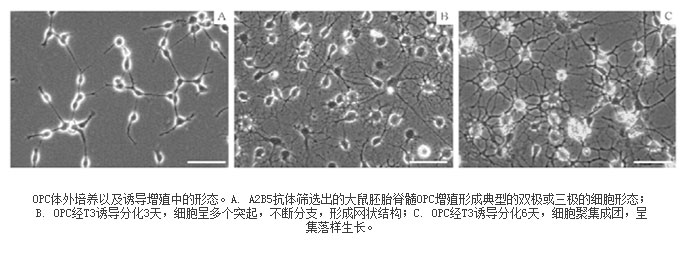
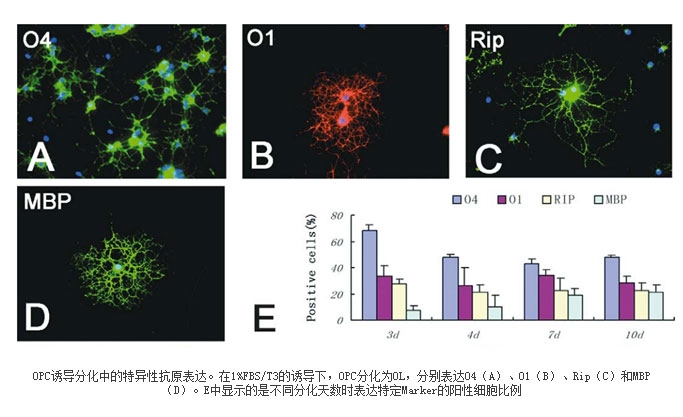
OPCs及其分化细胞的特性通过形态学观察和免疫化学染色法鉴定。在包被的基底面上,OPC细胞呈贴壁生长。胞体透亮略呈纺锤形,并伸展出对称的双极或三极的细长突起,显示了典型的OPC形态特征(图1A)。用含有T3的分化培养液替换原来的OPC培养液,2-3天后,OPC失去了原有的形态特征,并伸展出多个细长突起,呈逐级分支的典型网状结构(图1B);6 ~8天后,细胞逐渐成熟或趋向老化,细胞呈蛛网状、OL样形态,部分细胞聚集成团(图1C)。免疫组织化学观察结果(图2)显示:经T3诱导分化后,细胞逐渐表达成熟前期或成熟OL的特异性蛋白O4、O1、RIP和MBP,并呈现出蛛网状、具有丰富的各级枝状突起的典型OL形态。
Copyright © 2008 - 2018 上海诺百生物科技有限公司 版权所有
技术咨询信箱:techsupport@novobiosci.com 订单查询信箱:sales@novobiosci.com
地 址:上海市闵行区顾戴路3100弄789号2楼 苏ICP备12010280号