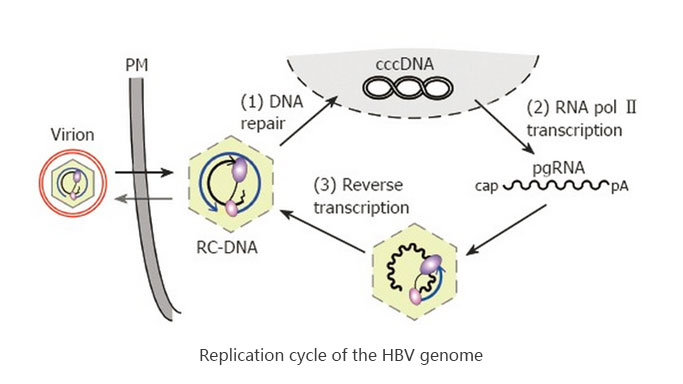
HBV一旦进入人体,病毒包膜表面上抗原大蛋白(LHBs)N端27~46位氨基酸就与肝细胞膜上的钠离子-牛磺胆酸协同转运蛋白(NTPC)结合,病毒颗粒通过受体介导的细胞内吞作用进入细胞,再由细胞微管系统转运至核孔复合物。HBV病毒是240个由两个核心蛋白(core protein,CP)以一定的夹角形成的二聚体亚单位,以一定的空间顺序结合形成的对称的20面体。病毒的CP经未知磷酸化机制暴露核内定位信号,与核孔复合物结合而脱去衣壳,HBV DNA进入核内,病毒颗粒由内吞到入核这一过程需要细胞内GTP激酶信号通路的参与。HBV DNA再经目前机制未明的修复正链缺口转变成超共价闭合环状DNA(cccDNA)。有研究在稳定转染HBV DNA和DHBV DNA的细胞株中分离到去蛋白rcDNA(protein free-rcDNA,PF-RC),并证明PF-RC是rcDNA到cccDNA转变过程的中间体,可能是在胞质核衣壳内,通过某种具有丝氨酸蛋白酶活性的物质切断P蛋白酪氨酸残基与负链5' 端磷酸基团间的磷酸二酯键形成的,rcDNA去蛋白化激发部分核衣壳解聚,暴露核定位信号,通过核孔复合体介导PF-RC转运到核内,然后由宿主细胞相关酶把PF-RC转化成cccDNA。用siRNA抑制核转运蛋白β1表达或表达功能缺陷的转运蛋白β1,均导致胞质PF-RC积聚,而胞核内PF-RC及cccDNA减少。细胞RNA多聚酶Ⅱ以cccDNA为模板,转录产生mRNA。病毒DNA聚合酶(即P蛋白)结合于pgRNA(前基因组RNA,也是3.5kb mRNA)5' 端的茎环结构,促使pgRNA包裹入核心颗粒中,P蛋白TP区第63位酪氨酸残基上的羟基与GTP共价结合引发合成5'-GAAT-3' 的四聚DNA引物,P蛋白与该引物转位到pgRNA3' 端DR1区,以pgRNA为模板转录合成互补性负链DNA,同时DNA聚合酶的RNAse H(核糖核酸酶H)切割模板pgRNA,仅保留5' 端完整的DR1片段,与该片段互补的短小RNA脱离并附着在负链5' 端,引导正链合成。当合成延伸到负链5' 端时,DNA聚合酶模板切换至负链3' 端继续合成正链DNA,形成松弛环状DNA(rcDNA),再移去共价结合在负链5' 端的病毒聚合酶和正链5' 端的短链RNA低聚物(用于启动),就形成了cccDNA。正链合成启动时,核心颗粒结构改变,成为成熟的核心颗粒,可与表面抗原相互识别,以芽生的方式形成完整病毒颗粒。包裹着衣壳的HBV-DNA再由膜包裹后分泌到细胞外,也可以重新脱去衣壳进入细胞核内,以维持细胞核内cccDNA的数量。如下图所示。
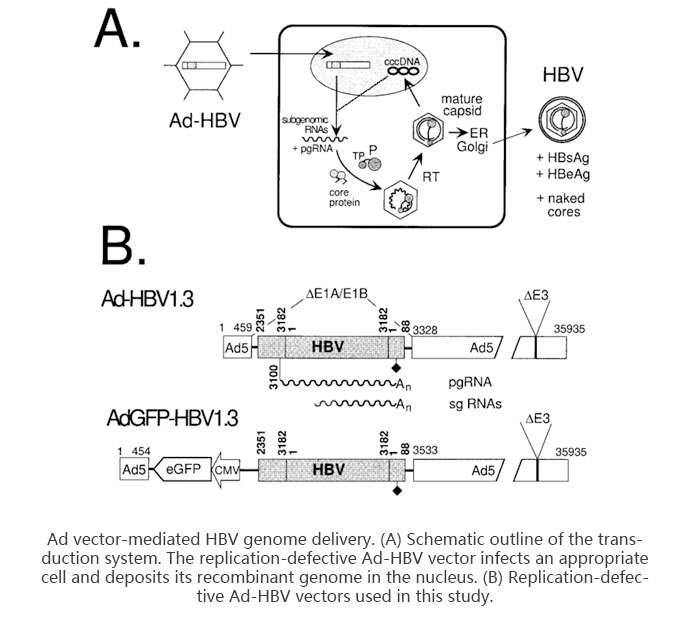
1.poly(dA-dT).poly(dT-dA)转染HepG2与HepG2.2.15细胞,qPCR检测I型干扰素IFN-beta、干扰素应答基因IFIT1与炎症因子TNF-alpha的表达,WB检测NF-kB、IRF3、TBK1以及磷酸化的TBK1的表达。
2.HBV1.3复制型质粒转染HepG2细胞,HBV siRNA转染HepG2.2.15,qPCR检测细胞中IFIT1的表达。
3.poly(dA-dT).poly(dT-dA)转染HepG2.2.15细胞,southern blot检测细胞内HBV的复制中间体,qPCR检测细胞上清中HBV颗粒,CMIA检测HBV s抗原与e抗原的表达。利用抑制剂阻断NF-kB、IRF3以及MAPK激酶信号通路,southern blot观察poly(dA-dT).poly(dT-dA)对肝细胞内HBV复制中间体的影响。WB检测细胞内ERK1/2的磷酸化。
1.Hepatitis B virus infection[J]. Lancet, 2014, pii:S0140-6736(14)60220-8. http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(14)60220-8/abstract
2.Hepatitis B virus X protein identifies the Smc5/6 complex as a host restriction factor. Nature. 2016 Mar 17;531(7594):386-9. http://www.nature.com/nature/journal/v531/n7594/full/nature17170.html
3.New therapeutic agents for chronic hepatitis B. Lancet Infect Dis. 2016 Jan 12;S1473-3099(15)00436-3. http://www.ncbi.nlm.nih.gov/pubmed/26795693
4.HBV-specific and global T-cell dysfunction in chronic hepatitis B. Gastroenterology. 2015 Dec 9;S0016-5085(15)01736-9. http://linkinghub.elsevier.com/retrieve/pii/S0016-5085(15)01736-9
5.Infection and Cancer: The Case of Hepatitis B. J Clin Oncol. 2016 Jan 1;34(1):83-90. http://jco.ascopubs.org/cgi/pmidlookup?view=long&pmid=26578611
Copyright © 2008 - 2018 上海诺百生物科技有限公司 版权所有
技术咨询信箱:techsupport@novobiosci.com 订单查询信箱:sales@novobiosci.com
地 址:上海市闵行区顾戴路3100弄789号2楼 苏ICP备12010280号